A continuación vamos a estudiar las principales características que poseen en común todos los gases: son fáciles de comprimir, se expanden hasta llenar todo el volumen de su contenedor, y ocupan mucho más espacio que en estado sólido o líquido. Los gases forman mezclas homogéneas entre sí compuestas por la unión de dos o más gases, y sus moléculas individuales están relativamente separadas, por lo que sus características físicas suelen ser por tanto similares, independientemente del gas que se trate.
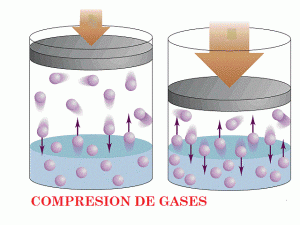
Compresibilidad:
Un ejemplo de esta característica lo encontramos en los motores de combustión interna, que se basan principalmente en la facilidad con la que un gas puede comprimirse. En el caso de un típico motor de cuatro tiempos, el pistón sale primeramente fuera del cilindro para crear una especie de vacío parcial. Posteriormente entre una mezcla de aire y vapor de gasolina, el pistón vuelve a entrar de nuevo y empuja la mezcla comprimiéndola hasta formar una explosión que será la encargada de mover el resto de engranajes.
Esta característica de compresibilidad es mucho más difícil de conseguir en estado líquido, y prácticamente imposible en estado sólido. Las únicas excepciones pertenecen a una serie de compuestos derivados del caucho natural o del caucho sintético. En el caso del típico ejemplo de una pelota de goma, resulta fácil de comprimir porque el material está relleno de aire.
Capacidad de expansión:
Un ejemplo claro y sencillo de esta característica se entiende muy fácilmente cuando pensamos en cualquier cocina donde se han horneado unas galletitas. Todo el aire de la cocina se llena de olores maravillosos, desgraciadamente, esta característica también funciona cuando alguien rompe un huevo podrido, donde el olor característico del sulfuro de hidrógeno se propaga rápidamente por toda la habitación. Debido a esta capacidad de expansión que poseen los gases para ocupar sus contenedores, podemos decir que el volumen de unas es igual al volumen de su contenedor.
El volumen que ocupa un compuesto en estado gaseoso es aproximadamente 800 veces mayor que en estado líquido. Esta característica ha sido aprovechada por la ciencia para evolucionar en el manejo de distintas herramientas. Un ejemplo muy claro lo encontramos en la máquina de vapor, que provocó la revolución industrial, y que se basa en el hecho de que al calentar el agua, se forma un volumen tan grande que al no caber dentro del recipiente, es expulsado a presión moviendo los engranajes que posteriormente, mueven todo el tren. Esta misma característica se utiliza en las explosiones de dinamita para acondicionar terrenos o eliminar rocas. En 1867, el químico sueco Alfred Nobel, descubrió que cuando se hacía detonar la dinamita, la nitroglicerina se descomponía para formar una mezcla de gases altamente comprimidos, como el dióxido de carbono, vapor de agua, nitrógeno y oxígeno.
Esta es la reacción:
4 C3H5N3O9 (l) —-> 12 CO2 (g) + 10 H2O (g) + 6 N2 (g) + O2 (g)
Debido a que por cada cuatro moles de líquido, se forman 29 moles de gas, y como hemos dicho antes, el gas ocupa un volumen 800 veces más grande que el líquido, esta reacción produce una onda de choque que destruye cualquier cosa en su proximidad.
Este mismo fenómeno, a una escala mucho más pequeña, ocurre cuando calentamos unas palomitas de maíz. El líquido aceitoso que se encuentra en el interior de la semilla se convierte rápidamente en gas, y la presión acumulada explota finalmente.
Presión frente a fuerza:
Otra de las características que podemos encontrar en un gas es la presión que ejerce sobre su entorno. Un ejemplo muy sencillo de esta característica, lo encontramos en los neumáticos de los coches o de las bicicletas. La presión del gas aumenta a medida que se añade más gas al recipiente.
Existe una importante diferencia entre la presión de un gas y la presión ejercida por un líquido o un sólido. Por ejemplo un camión de 20 t ejerce toda su presión sobre la superficie de las cuatro ruedas, sin embargo, la presión de un gas es ejercida en todas las direcciones.
A principios del siglo XVII, Galileo argumentaba que era posible succionar el agua de un pozo mediante bombas de vacío. Años después, el físico italiano Torricelli, propone que el aire de nuestra atmósfera tiene cierto peso y que aplica una fuerza que empuja hacia abajo que hace que el agua encuentre como única vía de escape la bomba de vacío. De esta manera se explica también que la atmósfera es un recipiente, y por lo tanto tiene su propia presión.
Torricelli experimentó con diferentes líquidos, y encontró interesantes resultados utilizando el mercurio. Mediante un dispositivo de tubos de vidrio, inventó el primer barómetro. Que mide literalmente el peso de la atmósfera. El resultado obtenido a nivel del mar indicaba que la presión de la atmósfera es equivalente a 760 mm de altura del mercurio; a este valor se le llamó atmósfera:
1 atm = 760 mmHg = 101.325 pascales
Características de distintos gases:
Aire: el aire que respiramos tiene un 78% de nitrógeno y un 21% de oxígeno. Mientras que el nitrógeno se comporta de manera bastante inerte, el oxígeno es un gas bastante reactivo que tiende a combinarse con otros gases.
Hidrógeno: H2, resulta un gas bastante inflamable y más ligero que el aire.
Helio: es un gas no inflamable, incoloro y más ligero que el aire.
Cianuro de hidrógeno: Hcn, se trata de un gas muy tóxico que históricamente ha sido usado para envenenar a las personas.
Ácido clorhídrico: Hcl, también llamado cloruro de hidrógeno, es un gas muy tóxico y corrosivo.
Sulfuro de hidrógeno: H2s, es un gas tóxico que huele a huevo podrido y que tiene una coloración rojiza.
Dióxido de carbono: co2, es un gas incoloro, inodoro, no tóxico, por lo que se debe aumentar la precaución cuando se usa en lugares cerrados. Mucha gente ha fallecido en invierno al utilizar quemadores de gas dentro de habitaciones cerradas. Al aumentar la cantidad de dióxido de carbono en el aire, podemos llegar a morir sin darnos cuenta.
Metano: ch4, se trata de un gas incoloro e inodoro, inflamable que puede obtenerse como subproducto ocasional del sistema digestivo, apareciendo en lo que comúnmente se denomina ventosidad.
Óxido nitroso: N2o, es un gas de olor dulce, incoloro, que en caso de respirar, tiene un efecto divertido que produce risa tonta, pero que también causa irritación en los ojos, nariz y garganta, y puede producir lesiones y alteraciones del sistema nervioso y de las células pulmonares
Dióxido de nitrógeno:NO2, es un gas tóxico, de color rojizo o marrón, y que se detecta por qué se caracteriza por un dolor muy irritante.
Amoníaco:NH3, es incoloro y tiene un olor acre.
Dióxido de azufre: SO2, es un gas incoloro que tiene un olor irritante.