Antes de definir las diferentes características de los líquidos, trataremos de definir qué es un líquidos: Un líquido es un estado de la materia, al igual que otros estados como el sólido o gaseoso. Por lo general, los líquidos toman la forma del recipiente en el que son colocados y su volumen se mantendrá constante a lo largo del tiempo.
Movimiento de partículas de un líquido:
Al observar las moléculas de un líquido, vamos a tratar de encontrar una similitud estudiando los dos ejemplos extremos, tanto del sólido como del gas. Podemos situarlas a nivel de movimiento en una zona intermedia entre la quietud del sólido, y el caos o aleatoriedad de los gases.
Las partículas que componen los elementos en estado sólido suelen presentarse de manera ordenada, formando una estructura tridimensional (los cristales de sal), cuyas fuerzas entre partículas son lo suficientemente fuertes como para que el sólido no sea compresible, ni tampoco fluya y tome la forma de un recipiente. En el caso extremo, los gases mantienen las partículas mediante fuerzas tan pequeñas que no existe casi restricción alguna sobre el movimiento, por lo que tienen libertad total para llenar el espacio total del recipiente. Tanto la forma como el volumen de un gas varían en función del recipiente.
Las partículas que componen los líquidos se mueven de una manera intermedia entre el sólido y el gas. Podemos hablar tanto de moléculas como de átomos, dependiendo de la naturaleza química de la sustancia a estudiar. Sus características generales serán las mismas, independientemente de su composición, pero en cambio las fuerzas de atracción entre las moléculas, pueden ser mayores que las fuerzas de atracción entre átomos, y por tanto que el líquido fluya con menos facilidad.
Mediante el enfriamiento, es posible disminuir la energía cinética de las partículas del líquido, y como resultado, eventualmente obtendremos un cambio de estado del líquido a sólido. Igualmente, es posible realizar el ejemplo contrario aumentando la energía cinética por calentamiento. El resultado obtenido será un cambio de estado de líquido a gas. Por ejemplo, un experimento realizado con agua bajo una presión de una atmósfera, tiene como resultado el cambio de líquido a sólido a la temperatura de 0 °C, y el cambio de líquido a gaseoso a la temperatura de 100 °C.
Tensión superficial:
La tensión superficial puede definirse como una fina capa que aparece sobre la superficie de un líquido, que hace que se comporte como si tuviera una fina piel. La tensión superficial es la culpable de que objetos pequeños o insectos minúsculos puedan soportarse sobre la superficie del líquido y flotar sin hundirse. Este fenómeno está causado por la atracción de las moléculas del líquido. Normalmente, las distintas moléculas del líquido se atraen por igual, sin embargo en la superficie, esta fuerza tiende a ser mayor ya que la última capa de moléculas orienta sus electrones hacia el interior del líquido.
La tensión superficial también será la responsable de marcar el tamaño de las gotas del propio líquido al caer. El tamaño de una gota de lluvia está dictaminado por la tensión superficial. Cuanto mayor sea la tensión superficial, mayor será el tamaño de la gota.
Muchas veces nos hemos preguntado ¿por qué lavan los jabones?. La respuesta a esta pregunta la encontramos en la tensión superficial. Realmente los jabones no lavan, lo que la es la fuerza de arrastre del agua al pasar por la suciedad. El problema que encontramos es que muchas superficies son tan estrechas y delgadas que la tensión superficial del agua impide al líquido penetrar y arrastrar las manchas. El jabón, disminuye la tensión superficial, consiguiendo gotas de agua mucho más pequeñas que son capaces de penetrar y atravesar casi cualquier superficie, arrastrando consigo los materiales o manchas que pretendemos limpiar.
Viscosidad:
La viscosidad es una característica exclusiva de los líquidos, que mide la capacidad o resistencia de un líquido a fluir. Los líquidos que fluyen fácilmente, como el agua, tienen una viscosidad muy baja. En cambio, los líquidos con viscosidades altas, como la melaza o el aceite industrial, fluyen más lentamente y con más dificultad.
La viscosidad puede medirse a través de varios experimentos. Por ejemplo podemos tomar el tiempo que tarda el líquido en fluir a través de un tubo capilar, o también podemos dejar caer una bola de acero sobre un recipiente graduado y medir el tiempo que tarda en atravesar el líquido. Obviamente, cuanto mayor sea el tiempo de medida, mayor será la viscosidad del líquido.
La viscosidad a nivel molecular depende exclusivamente de las fuerzas de atracciones de las moléculas del líquido y en menor medida de la presencia de componentes estructurales. La temperatura, también es un factor que afecta en gran medida la viscosidad del líquido. Generalmente, a medida que aumenta la temperatura, disminuye la viscosidad. Esto se debe a que al aumentar la energía cinética de las partículas, las fuerzas de atracción infernales disminuyen.
Cohesión:
La cohesión también puede definirse como la fuerza de atracción que mantiene las moléculas unidas. Esta fuerza mantiene a los líquidos y los sólidos permitiendo la sustancia existir ocupando un volumen, mientras que en el caso de los gases, dicha fuerza es tan pequeña que la sustancia puede llegar a desperdigarse y disolverse en el ambiente.
La fuerza de cohesión es la que permite que dos gotas de agua puedan unirse para formar una gota mayor. Esta característica resulta muy notable cuando juntamos dos bolitas de mercurio.
Adherencia:
Se define adherencia como la atracción que manifiestan las moléculas de dos sustancias diferentes, por lo general entre un líquido y sólido. Generalmente las sustancias líquidas se adhieren a las sustancias sólidas, tal como el agua se adhiere al vidrio, el aceite se adhiere a la ropa, o la tinta de un bolígrafo se adhiere al papel.
Si la diferencia es mayor que la cohesión, el líquido se esparce sobre la superficie del sólido. Podemos decir que este fenómeno se conoce comúnmente como mojar. Por el contrario, si la cohesión es mayor que la adherencia, el líquido tendrá tendencia a mantener su forma, por lo que resbala y no moja. Un caso extremo, lo observamos si colocamos una gota de mercurio sobre un cristal. El Mercurio conservará su forma de gota, sin mojar.
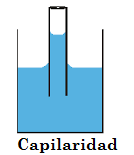
Capilaridad:
Se conoce la capilaridad, como el fenómeno que permite a los líquidos ascender o descender dentro de un tubo de diámetro pequeño llamado capilar (Menos de 1 mm de diámetro). La capilaridad, se basa en la combinación de las fuerzas de cohesión y adhesión en combinación con la tensión superficial.
Gracias a esta característica se producen varios fenómenos naturales, como la absorción del agua por parte de las raíces de las plantas, o la distribución de la sabia a lo largo del tallo. También podemos encontrar este fenómeno dentro de la circulación sanguínea de nuestro cuerpo, no en vano, los vasos sanguíneos más pequeños se denominan capilares.
Densidad:
La densidad de un líquido puede definirse como la cantidad de masa por unidad de volumen. Se expresa en el sistema internacional por kg/m3, y su valor se determina al dividir la masa entre el volumen ocupado.
Siempre se utiliza como ejemplo que el Mercurio pesa más que el agua, pero se debería utilizar el concepto de densidad, y no el peso, para expresar el Mercurio simplemente tiene más materia en igualdad de volumen. Para determinar la densidad de los líquidos podemos utilizar instrumentos llamados “Densímetros”.
Cristales líquidos:
Se denomina “cristal líquido” como un estado intermedio entre sólido y líquido. Existe un punto específico a cierta temperatura, en el que los líquidos adquieren este comportamiento intermedio cercano al Estado sólido. Apenas basta comentar un poco la temperatura para que la estructura cristalina desaparezca. En 1888, el químico y botánico austriaco Friedrich Reinitzer, descubrió la sustancia benzoato de colesterol, que a 145 °C formaba una especie de gelatina o cristal lechoso, y a 179 °C el líquido se volvía transparente.
Los vidrios:
Los vidrios son el origen líquidos sobre enfriados, que forman sólidos no cristalinos. El ejemplo más frecuente que podemos encontrar de vidrio, es el dióxido de silicio, muy utilizado para los cristales de las ventanas. Cuando el dióxido de silicio es calentado a 1600 °C, se forma un líquido viscoso. Un enfriamiento rápido genera enlaces entre el silicio y el oxígeno, formándose de esta manera un patrón regular en estado sólido. De igual manera, podemos variar las características del vidrio: dureza, fragilidad, resistencia, color… Añadiendo al líquido original distintas cantidades de óxidos ácidos, plomo, fósforo, oxidos metálicos u otros compuestos.