A continuación en este texto vamos a intentar describir todas las características, así como las aplicaciones en las que se usan los más de 70 metales de la tabla periódica, que hoy en día se conocen.
Características químicas:
Los metales tienen la capacidad de combinar con otros metales y también con algunos no metales para formar un gran número de aleaciones, y de esta forma mejorar sus funciones específicas y mejorar sus características. Por ejemplo, podemos combinar el hierro con el níquel y con el cromo obteniendo una serie de aleaciones de acero inoxidable, muy utilizadas hoy en día. También es posible combinar los metales con productos derivados del petróleo. De esta forma se obtienen plásticos mejorados con características diferentes, como por ejemplo, distinto brillo, resistencia a la llama, resistencia a la degradación… Aquí los metales que mejor combina con los productos químicos orgánicos del petróleo, son los siguientes: el níquel, el vanadio, el molibdeno, el cobalto, los metales del grupo del platino y las tierras raras.
Características mecánicas:
podemos mejorar las estructuras y la maquinaria si mejoramos las características de resistencia y ductilidad de los metales. Muchas aleaciones permiten conseguir están ductilidad, y una maleabilidad que hacen que el metal sea capaz de deformarse, pero sin llegar a romper. De este modo podemos obtener vigas de acero, resistentes a los terremotos, muy útiles para la construcción. Podemos fabricar marcos de aluminio para puertas y ventanas, acuñar monedas de todo tipo, latas de metal para conservar alimentos, y una variedad de elementos de fijación, como por ejemplo los clavos, los clips, las grapas… Etcétera.
Al mejorar otro tipo de características como la compresión, que es la fuerza del metal bajo presión, o como la tracción, o las fuerzas de cizallamiento, se consiguen materiales ideales para la formación de estructuras de edificios, de automóviles, de puentes, e incluso de aeronaves.
Conductividad:
Los metales son excelentes conductores del calor y de la electricidad. En general, a menor temperatura, mayor conductividad, y al contrario, cuanto mayor es la temperatura menor conductividad tiene. De este modo, se puede deducir que al alcanzar la menor temperatura posible, llamada cero absoluto, -273 °C, la conductividad será infinita. Esta característica es denominada como superconductor. La conductividad térmica es otra de las características que son aprovechadas en distintos aparatos, como por ejemplo los radiadores de los automóviles, o los utensilios de cocina. La conductividad eléctrica proporciona la capacidad de poder transportar la electricidad largas distancias desde la fuente generadora hasta nuestros hogares. La mayoría de aparatos y electrodomésticos se basan en la conductividad eléctrica, como por ejemplo los televisores o los ordenadores.
Resistencia al desgaste, corrosión, fatiga y temperatura:
Los metales en general son duros y resisten muy bien el paso del tiempo. Muchos de estos metales necesitan tener características que resistan la corrosión, como por ejemplo aquellos que se utilizan en las plantas químicas, en la producción de alimentos, para aplicaciones médicas, o aquellos metales que tengan que estar en contacto con el agua, como el caso de la fontanería y de las baterías.
La característica de resistencia el desgaste es muy necesaria para todos aquellos utensilios que necesitan rodamientos, ya sea en modos de transporte, o máquina herramienta.
La resistencia a la temperatura es esencial para metales que constituyan la fabricación de motores a reacción, o incluso para los filamentos de las bombillas.
Características ópticas:
Los metales, por lo general, son brillantes en toda su extensión, a excepción del cobre y del oro que son plateados con tonalidad grisácea. Esta característica se debe a que todos los metales absorben la luz desde todo tipo de frecuencias. Esta cualidad permite la fabricación de espejos, y la apariencia atractiva de su brillo, es esencial y muy importante para el mundo de la joyería y de la numismática.
Características magnéticas:
Muchos metales tienen características ferro magnéticas, que atraen el hierro. Algunas aleaciones son magnetizadas a propósito para posteriormente usarse en motores, generadores, equipos de audio, altavoces eléctricos…
Características de emisión:
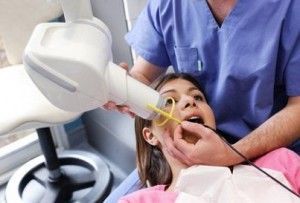
Cuando los metales se exponen a radiación, como por ejemplo haces de luz, o cuando se someten a altas temperaturas, son capaces de emitir electrones. Este fenómeno de emisión de electrones se utiliza sobre todo para la fabricación de pantallas de televisión. Muchos instrumentos electrónicos están basados en el uso de óxidos de tierras raras. Pero también ocurre al revés, de manera inversa, algunos metales como el plomo son capaces de absorber la radiación, y por ello se utilizan para la protección. Como por ejemplo los delantales que usan los dentistas durante las pruebas de rayos X.
Conclusión final:
Podemos concluir diciendo que los metales, en general, son sólidos brillantes a temperatura ambiente, excepto el Mercurio que es un elemento líquido brillante, y que tienen puntos de fusión muy altos. También se caracterizan por tener altas densidades, radios atómicos grandes, bajas energías de ionización, baja electronegatividad, esto es debido al hecho de que los electrones en la última capa de valencia son fáciles de perderse. También, otra característica común de los metales, es su capacidad para deformarse sin romperse. La maleabilidad, la ductilidad, y por último, la buena conducción tanto del calor como de la electricidad.